Tief ins Gehirn werden zwei Elektroden geschoben. Über einen Schrittmacher am Schlüsselbein kann so hochfrequenter Strom in unser Hirn geleitet werden – und den Zielort im Kopf elektrisch stimulieren. Das klingt nach Sciencefiction, ist aber eine wahre Revolution der Neurotechnologie. Schon seit 30 Jahren pflanzen Chirurg:innen zum Beispiel Parkinsonerkrankten solche Elektroden ins Gehirn. Nun sollen künstliche Synapsen diese Technologie noch weiterdenken. Mit möglichen Vorteilen – aber auch potenziellen Risiken. Und letztlich sind all diese Technologien auch ein ethisches Wagnis.
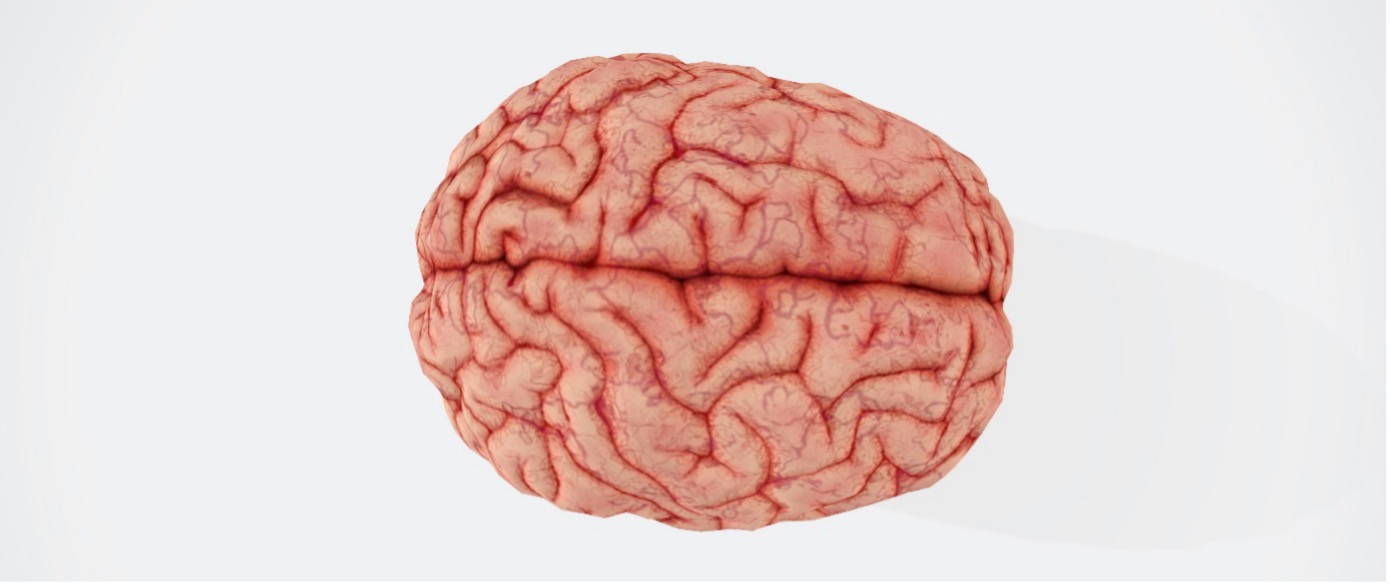
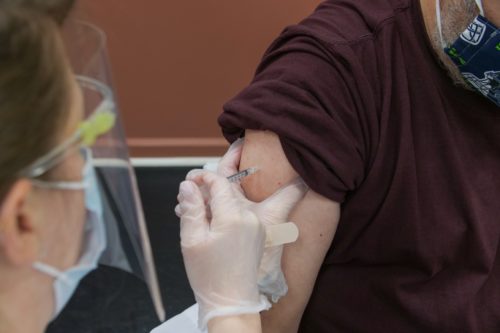
Foto: Das menschliche Gehirn ist unser kompliziertestes Organ – und dennoch können wir es heute schon eleketrisch stimulieren. Credits: unsplash/aresbuddhi
Unser Gehirn ist das komplexeste und unerforschteste Organ des Menschen. Es ist von einem Netz aus 100 Milliarden Nervenzellen durchspannt. Sie sind miteinander verknüpft. Kommunizieren miteinander. Ihr Mundwerk: die Synapsen. Darüber können wir Sinneseindrücke wahrnehmen und denken. Dazu kommt zunächst ein elektrisches Signal, ein Befehl, an einer Nervenzelle an. Nur wenn das Signal stark genug ist – der Befehl laut genug – wird er über die Nervenleitung der Zelle zu den Synapsen am anderen Ende geleitet – und so verarbeitet. Die Nervenzelle fängt an zu sprechen. Denn der elektrische Impuls sorgt dafür, dass chemische Botenstoffe freiwerden. Also Befehle, die wiederrum die folgende Zelle verstehen kann. Ist die nächste Nervenzelle einmal so angeregt, kann auch sie ihren Nachbarn ansprechen und so die Befehle weitergeben.
Wenn Proteine den Redefluss stören
Im Alter kann diese Kommunikation gestört werden. Einzelne Nervenzellen gehen kaputt und weitere werden dadurch inaktiv. Auch steigt das Risiko, dass neurodegenerativen Erkrankungen wie Parkinson entstehen. Noch sind die Ursachen davon nicht ausreichend verstanden, sagt Wolf-Julian Neumann, Professor an der Klinik für Neurologie an der Charité Berlin. Bekannt ist aber, dass Populationen von Nervenzellen tief im Gehirn untergehen – solche, die Dopamin produzieren. Dopamin ist einer der Botenstoffe und unter anderem wichtig für Bewegung, Motivation und Belohnung, erklärt Neumann. Diese Dopaminnervenzellen tief im Mittelhirn sterben ab, weil sich dort Proteine ausbreiten, die krankhaft sind. So verhindern sie, dass elektrische und neurochemische Signale bei benachbarten Hirnarealen ankommen. Reden können die Nervenzellen im Gehirn dann nicht mehr alle. „Und dann gibt es da unter anderem einen ganzen bunten Strauß von genetisch ausgelösten, atypischen Parkinsonerkrankungen“, ergänzt Volker Arnd Coenen, Professor und Facharzt für Neurochirurgie sowie ärztlicher Leiter der Abteilung der Stereotaktischen und funktionellen Neurochirurgie am Uniklinikum Freiburg.
Mediziner:innen behandeln Parkinson heute zunächst mit Medikamenten, wie Agonisten. „Die Agonisten sind eine Stoffklasse, die dazu führt, dass das noch vorhandene Dopamin schlechter oder weniger abgebaut wird“, erklärt Coenen. Auch gibt es Wirkstoffe, die ein Vorläufer des Botenstoffs sind und dem Dopamin ähneln. Im Gehirn werden diese zu Dopamin umgebaut und können den dortigen Mangel zu einem gewissen Grad ausgleichen. Doch: „Nach einer gewissen Zeit ist es so, dass die medikamentöse Wirkung nicht mehr ganz so langanhaltend ist wie vorher, dann sucht man Therapiealternativen“, ergänzt Neumann.
Ein elektrischer Sprachassistent für Nervenzellen
Eine dieser Alternativen ist die elektrische Stimulation. Im fortgeschrittenen Stadium von Parkinson, wenn zum Beispiel Stand- und Gehschwierigkeiten auftreten, setzen Chirurg:innen elektrische Hirn-schrittmacher ein. Die Technologie dahinter nennt sich Tiefe Hirnstimulation (THS), erklärt Coenen, der diese Schrittmacher selbst implantiert: Bereits in den 70er-Jahren wurde sie bei chronischen Schmerzen eingesetzt. Durchsetzen konnte sie sich aber erst, nachdem sie der Franzose Alim-Louis Benabid mit dem Neurologen Pierre Pollak 1986 gegen Muskelzittern entwickelte. Seit 1996 ist sie dafür in Europa zugelassen. Wie in einer Studie im Journal Of Neurosurgery deutlich wird, war es ebenfalls Benabid, der 1993 die erste Stimulation in der Hirnregion Nucleus subthalamicus durchführte – dort, wo heute meist bei Parkinson stimuliert wird.
Aber wie genau funktioniert das bei Parkinson? Für die THS schieben Neurochirurg:innen zwei Elektroden in die Tiefe des Gehirns der Patient:innen. Die anderen Enden der Elektroden laufen in einem Schrittmacher zusammen, der auf Höhe des Schlüsselbeins implantiert wird. Über den Schrittmacher kann dann Strom mit sehr hoher Frequenz von über 100 Hertz ins Gehirn geleitet werden, sodass der Zielort elektrisch stimuliert wird. „Typischerweise stimuliert man die Region Nucleus subthalamicus. Das ist eine Struktur, die bei Parkinson-Erkrankten überaktiv ist und die versucht man in ihrer Funktion zu zähmen“, beschreibt Coenen. Dafür muss der Schrittmacher nach der Operation passend zu den Symptomen programmiert werden.
Damit kann Parkinson zwar nicht geheilt, aber die Symptome können gemildert werden. „Das Haupt-problem der Patient:innen ist, dass sie sich nicht gut bewegen können. Und diese Bewegungsverlangsamung kann man mit der THS sehr gut behandeln. Sie ist auch genauso effektiv fürs Zittern“, betont Neumann. Die THS hilft also die Kommunikation der Nervenzellen zu regulieren. Ihren Mund nicht zu viel und nicht zu wenig aufzumachen – so, dass die Befehle wieder verständlich sind. Coenen schätzt die Erfolgschance der Implantation bei optimal angepasster Stimulation auf etwa 80 Prozent. Und der Erfolg zeige sich auch: „Wir sagen den Patienten, wenn wir anfangen zu behandeln, dass wir die Krankheit um circa fünf Jahre zurücksetzen. Man hat aber dauerhaft gute Effekte mittlerweile bis 15 Jahre nachgewiesen. Aber natürlich ist der Effekt nach 15 Jahren nicht mehr so toll, wie am Anfang“, beschreibt der Neurochirurg. Kliniken wie das Uniklinikum Freiburg, an dem Coenen arbeitet, machen heute 40 bis 60 THS pro Jahr. „Hochgerechnet werden wahrscheinlich im Jahr 400 Implantationen in Deutschland gemacht“, schätzt Coenen.
Bei Risiken und Nebenwirkungen
Das aber nicht ohne Risiken und Nebenwirkungen: „Je ungenauer und unpräziser implantiert wird, desto mehr Probleme mit Nebenwirkungen kann man haben“, erklärt Neumann. „Ähnlich wie bei der medikamentösen Behandlung kann es zu Überbeweglichkeit kommen. Die Verständlichkeit des Sprechens kann sich verschlechtern. Und es kann sein, dass ein Kribbeln auftritt, das würde man dann aber immer direkt behandeln, indem die Stimulation neu eingestellt wird“, berichtet der Neurologe.
Früher soll es Abstoßungsreaktionen des Gehirns gegenüber den Materialien der Elektroden gegeben haben. Für die heute verwendeten Metalle Platin und Iridium ist das aber kein Problem mehr, sagt Coenen. Zudem werden die Elektroden mit Silikon oder dem Kunststoff Polyurethan ummantelt, die der Körper typischerweise nicht angreift. „Es gibt immer mal jemanden, der allergisch drauf reagiert, das ist aber ganz selten“, versichert der Neurochirurg. Stattdessen ergänzt Neumann, dass mögliche Infektionen eine etwas größere Sorge wären. „In seltenen Fällen kann es bei Patient:innen mit geschwächtem Immunsystem zu Infektionen am Implantat kommen.“ Auch könnten im Bereich der Elektroden bei der ersten Implantation temporär Wassereinlagerungen entstehen. „Sie stehen unter Verdacht, vorübergehend für kognitive Defizite zu sorgen. Dies ist jedoch nicht eindeutig erwiesen“, erläutert Neumann.
Die THS als künstliche Synapse weitergedacht
Lassen sich diese Nebenwirkungen noch minimieren und eine noch zielgerichtetere Behandlung finden? Das versucht Katarzyna Krukiewicz, Professorin für Physikalische Chemie und Polymertechnologien an der Schlesischen Technischen Universität im polnischen Gliwice. Sie forscht an einer anderen technischen Behandlung von Parkinson. Die Vision: Künstliche Synapsen entwickeln. Also das Mundwerk, das das Gehirn besitzt, imitieren. „Wenn wir wissen, dass eine bestimmte Nervenzelle nicht mehr richtig funktioniert, können wir versuchen, eine Art Bypass einzubauen“, erklärt Krukiewicz ihren Ansatz. Und die Idee ist nicht ganz neu: Ein schwedisches Forscherteam um Daniel Simon von der Linköping Universität lieferte im Fachjournal IEEE schon eine winzige Pumpe als Prototyp für eine künstliche Synapse. Weitere Forscher:innen um Scott Kenne von der Standford University berichteten zudem in einer Studie in nature materials über einen Synapsenersatz, bei dem sich zwischen zwei weichen Kunststoffen Botenstoffe bewegen können. So wurde die Weitergabe von Befehlen zwischen zwei Nervenzellen – die hier die beiden Kunststoffe sind – nachgebaut.

Krukiewiczs Team will nun eine winzige Kapsel bauen, die als Synapsenersatz an beschädigte Nervenzellen implantiert werden soll. Sie soll aus einem weichen Material bestehen, einem Kunststoff. Im Inneren der Kapsel sollen dann die Botenstoffe gelagert sein, so die Vorstellung der Forschenden. Der weiche Kunststoff soll elektrische Impulse empfangen und darauf reagieren können, indem er die Botenstoffe aus dem Inneren der Kapsel freigibt. Bei einer Erregung der Nervenzelle soll er zum Beispiel Dopamin ausschütten, wie eben eine natürliche Synapse – und so letztlich die Kommunikation der Nervenzellen wieder passend regulieren. Der weiche Kunststoff soll also irgendwann auch die Sprache der Nervenzellen verstehen und die Befehle an seine Nachbarzellen weitergeben können.

Dazu haben die Wissenschaftler:innen um Krukiewicz Simulationen am Computer erstellt und in Laborexperimenten untersucht, welche Materialien für ihre künstliche Synapse infrage kommen. Erste Ansätze dazu existieren schon, aber „noch kein perfekter“, erklärt Krukiewicz. Ihr Kunststoff soll nun alle wichtigen Eigenschaften vereinen: Er soll biokompatibel – also mit dem Gehirn verträglich sein – zudem elektrisch leitend und so schnell reagieren können wie Nervenzellen. Außerdem soll er möglichst immun gegen Bakterien oder andere Erreger sein, damit keine Infektionen im Gehirn entstehen. Zudem sollen die Botenstoffe durch die elektrische Stimulation an der richtigen Stelle und nur bei Bedarf freigesetzt werden. Und: Die künstliche Synapse darf nur ein paar Nanometer groß sein – wie es eben natürliche Synapsen auch sind. Der Weg zum fertigen Synapsenersatz ist also noch beschwerlich.
Impulsiv geworden durchs Implantat
Mikrokapseln, die Synapsen imitieren sollen, elektrische Stimulation, Elektroden im Gehirn, die von außen gesteuert werden können: Heute sind diese Ideen medizinisch nicht ungewöhnlich – oder im Fall der Tiefen Hirnstimulation sogar schon jahrzehntelang in Anwendung. Gibt es da keine ethischen Bedenken? „Ethische Bedenken sind immer im Kontext der individuellen Therapie zu berücksichtigen“, erklärt der Neurologe Wolf-Julian Neumann in Bezug auf die THS und betont: „Der Zugewinn an Lebensqualität für die Patient:innen steht für uns im Vordergrund.“ Der Neurochirurg Conen ergänzt, dass er die mögliche Impulsivität durch die THS für das größte ethische Problem hält: In wenigen Fällen verhalten sich Patient:innen nach der OP nämlich impulsiver. Und: „Es hat einen Fall in Italien gegeben, wo ein Patient mit einer tiefen Hirnstimulation pädophile Tendenzen gezeigt hat“, erklärt Coenen. „Aber da muss man sehr klar sagen, dass die Pädophilie in diesem Kopf drin gewesen ist. Sie ist nur freigelassen worden, weil man das Niveau der Impulsivität verändert hat.“
In Australien wurden außerdem in einem Artikel von Liam Drew in nature medicine wirtschaftliche Risiken von Verfahren wie der THS aufgedeckt: Die Epileptikerin Rita Leggett wurde laut einem Artikel in nature mit einem Implantat in ihrem Kopf behandelt, doch die Herstellerfirma des Implantats ging insolvent. So musste der Chip wieder entfernt werden, obwohl er sehr gut wirkte. Der Kopf der Patientin musste also zweimal geöffnet werden – weil nicht sichergestellt wurde, dass die Materialien des Implantats auf Dauer verfügbar sind. Das macht den Eingriff am Gehirn zusätzlich ethisch bedenklich, gibt Coenen zu. Jedoch müssen die Hersteller die Teile laut Coenen bis zu drei Jahre nach Implantation vorhalten. In seiner Klinik käme es nur im Einzelfall vor, dass Teile von kleineren Herstellern implantiert werden. „Das größte Problem ist dann, dass man nochmal ins Gehirn muss und die Elektrode austauschen muss. Das hat natürlich ein gewisses Risiko. Aber die allermeisten Hersteller, mit denen wir arbeiten, die sind seit über einem Jahrzehnt oder teilweise seit über 40 Jahren auf dem Markt – da muss man sich keine Sorgen machen“, betont er.
Ethische Bedenken darüber, dass die Hirnschrittmacher gehackt, das Gehirn so etwa fremdgesteuert werden könnte oder sich gar neue Hirnfunktionen ausbilden, haben die beiden Experten nicht. „Solche ethischen Fragen werden dann relevant, wenn wir über die Zukunft sprechen, wobei eine Funktionsausweitung des Gehirns und ähnliche Science-Fiction-Szenarien noch weit von der Realität entfernt sind“, versichert Neumann.
Musks Revolution – von was eigentlich?
Das gelte auch für die Visionen des reichsten Mannes der Welt: 2016 gründete Elon Musk in San Francisco das Unternehmen Neuralink. Das Unternehmen soll Pionier in Implantaten sein, mit denen Gehirne mit Computern kommunizieren können. Anfang 2024 bekam Neuralink viel Aufmerksamkeit in den Medien, weil dem gelähmten Noland Arbaugh als ersten Patienten ein Hirnimplantat von Neuralink eingesetzt wurde. Nach seiner Operation postet Arbaugh auf X Videos, wie er in seinem elektrischen Rollstuhl sitzend, mit seinen Augen seinen Cursor auf dem Computer steuert – offenbar nur mit der Kraft seiner Gedanken. Neuralink forscht mit ihm weiter, möchte „die Leistung der Cursorsteuerung auf das gleiche Niveau wie bei gesunden Menschen bringen“, schreibt das US-Unternehmen. Und nach Musks Vorstellung soll Neuralink irgendwann sogar das menschliche Denken auf eine neue Stufe heben. Der Milliardär möchte langfristig die Hirnfunktionen gesunder Menschen verbessern und sie besser machen als künstliche Intelligenz, schreibt er am 20. September 2023 auf X.
Sind US-Firmen wie Neuralink und Konkurrenten wie Blackrock Neurotech und Synchron damit also schon viel weiter als die THS und Katarzyna Krukiewicz mit ihren Ansätzen für künstliche Synapsen? Nein, sagen Neumann und Coenen. Das, was von Musk als neuartiger Ansatz beworben wird, ist es nicht. Denn: Was von Neuralink da implantiert wurde, ist weder mit Tiefer Hirnstimulation noch mit künstlichen Synapsen vergleichbar: „Es sind einfach kleinere Elektroden, die mit Tausenden von Kontakten verschiedene Hirnareale messen und stimulieren“, erklärt Neumann. „Die Steuerung des Computercursors wie im Neuralink-Video zu sehen, könnte genauso gut erreicht werden, indem man Augenbewegungen oder Muskelaktivität nutzt.“ Auch Coenen versichert, dass das alles schon mal in den 90er-Jahren gezeigt worden ist. Damit ist das Implantat von Neuralink auch keine Therapie: „Das hat gar nichts therapeutisches. Im Gehirn hat keine Veränderung der Erkrankung stattgefunden. Das war gar nicht das Ziel“, betont Neumann. Neuralink sei damit aber nicht per se schlecht. Die Wissenschaftler:innen dort könnten durchaus Interesse haben, Hirnerkrankungen therapeutisch zu behandeln, vermutet Neumann. „Das, was wir in den Medien wahrnehmen, sind Statements, die Investoren locken sollen.“ Seine Technologie auch an gesunde Menschen zu adressieren, nutze Musk, weil es eben viel mehr gesunde als Menschen mit Gehirnerkrankungen gibt.
Musks Pläne, Hirnfunktionen zu erweitern, seien „zumindest mal bedenkenswert“, so Coenen. Das werde aber früher oder später kommen, schätzt der Experte. „Ich warte eigentlich nur darauf, dass hier ein Ehepaar reinkommt und mir sagt, dass der sechsjährige Sohn schlau und der Achtjährige ein bisschen blöd ist und ob ich ein Implantat für den Älteren habe.“